多中心研究IDH野生型分子胶质母细胞瘤(molecular glioblastoma)的生存情况
Abstract
组织学上定义的胶质母细胞瘤(GBM)为否存在中央假栅栏坏死和微血管增生(histGBM)。根据2021年WHO中枢神经系统肿瘤分类手册将IDH野生型弥散性星型胶质瘤,包括任一的分子特征:1)TERTp突变,2)EGFR基因扩增,3)七号染色体获得与十号染色体缺失,且无论是否存在中央假栅栏坏死和微血管增生定义为分子GBM(molGBM)。本研究是为了探究histGBM与molGBM患者间的生存差异。
Introduction
一般而言,胶质母细胞瘤(GBM)WHO4级由组织学上是否存在中央假栅栏坏死和微血管增生 (histGBM)给出。然而,现在在一些弥漫性低级别胶质瘤(2级或3级)中可以观察到与4级肿瘤相似度侵袭性行为。在2018 年,中枢神经系统 (CNS) 肿瘤分类学的分子和实用方法信息联盟 (cIMPACT-NOW) 提议将这一侵袭性弥漫性星形细胞肿瘤亚组重新分类为 WHO 4 级胶质瘤。在以前的分类上,根据这些肿瘤的组织学特征,分类为为2级或3级,但cIMPACT-NOW根据一些分子特征将其一致分为弥散性星型细胞瘤GBM(WHO 4)。分子GBM(molGBM)现在被诊断为基于以侵袭下任一伴随的分子特征:1)TERTp突变,2)EGFR基因扩增,3)七号染色体获得与十号染色体缺失。的IDH野生型(IDH-wt)肿瘤。特别地,2021更新的WHO中枢神经系统肿瘤分类手册将MolGBM定义为“IDH-wt GBM”无论其是否存在中央假栅栏坏死或微血管增生。
先前的研究已经报道了molGBM的总体生存期与histGBM的相似,然而其无进展生存期还未明了。并且molGBM与histGBM间OS或PFS的临床特点关联也是尚未明确的。本文多中心的目标就是为了评估molGBM与histGBM患者间的临床特征和生存情况。
Method
患者选择
我们回顾性审查了从 2017 年 11 月到美国三个不同地理区域(佛罗里达州、明尼苏达州和亚利桑那州)的三个三级护理中心获得 GBM IDH 野生型组织学和分子诊断的所有连续患者的电子病历 2021 年 10 月。初始诊断时数据不可用或诊断后未接受放化疗的复发性疾病患者被排除在分析之外。
临床特征
在电子病例中保留了以下数据:
1)诊断年龄 2)性别 3)诊断日期 4)死亡事件或最后随访时间 5)种族 6)术前KPS
组织学特征保留了:
1)TERTp突变 2)EGFR基因扩增 3)七号染色体获得与十号染色体缺失 4)中央假栅栏坏死 5)微血管增生 6)IDH突变状态 7)MGMTp甲基化状态(基于PCR)
将上述数据根据组织学特征分为两组
1)IDH-wt 包含中央假栅栏坏死或微血管增生为histGBM
2)IDH-wt 未包含中央假栅栏坏死和微血管增生,但包含TERTp突变或EGFR基因扩增或七号染色体获得与十号染色体缺失为molGBM。
OS 定义为从最初的病理诊断到死亡的日期,PFS 定义为从最初的病理诊断到影像学进展的日期。
放射线特征
从成像报告中提取了以下变量:偏侧性、位置、与侧脑室 (LV) 的接触、存在对比增强和切除范围。 切除范围分为活检(未进行肿瘤切除时)、次全切除(术后影像学证据显示残留肿瘤)和大体全切除(术后影像学影像未发现肿瘤残留时)。
Result
患者选择
我们在 2017 年 11 月至 2021 年 10 月期间连续筛选了 798 名在我们机构诊断为 IDH 野生型胶质母细胞瘤的患者。708 名患者符合纳入标准并被纳入总体分析。 只有 231 名患者对其组织进行了分子测试,并且在该子集中进行了子分析,以便能够在分析中包含分子变量。
人口统计学,临床和放射线特征
在231名患者中166(71.86%)为histGBM,65(39.16%)为molGBM。
在 molGBM 组中,22 名患者(33.85%)为 65 岁或以上,22 名患者(33.85%)为女性。 大多数患者是非西班牙裔白人(n = 61, 93.85%)。 15 名患者(23.08%)的 KPS 为 70 或以下。 影像学上,17 个肿瘤 (26.15%) 与侧脑室接触,38 个 (58.46%) 肿瘤在 T1 加权图像上显示对比增强,只有 13 个 (20%) 的 MRI 特征与 GBM 有关。 该组中的大多数患者仅接受了活检(n = 32, 49.23%),明显多于 histGBM 组的患者(p < 0.001)。
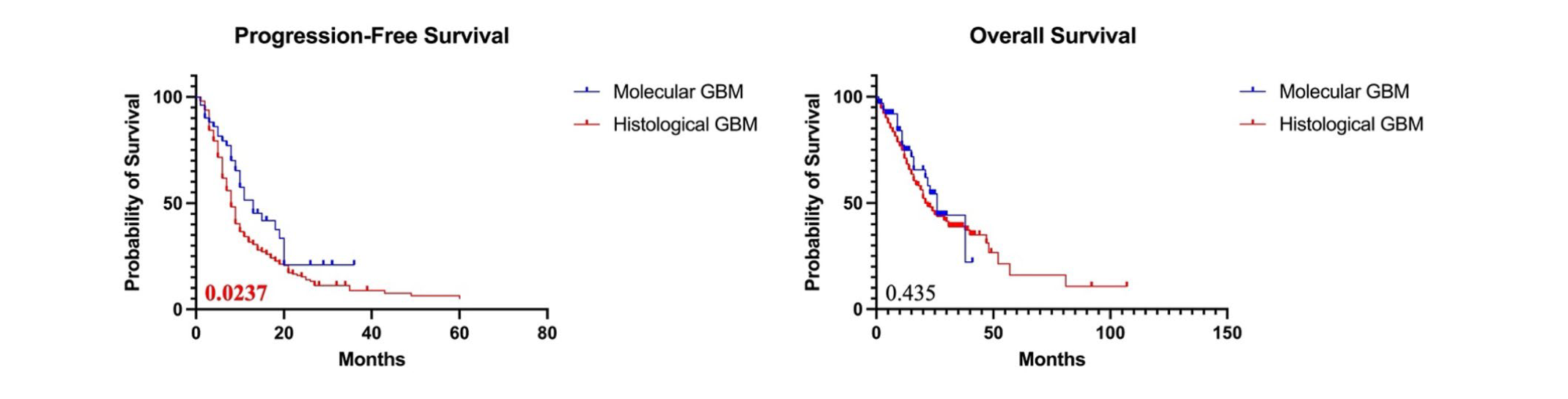
molGBM PFS优于histGBM
如图一所示,molGBM中位PFS为13个月而histGBM为8个月(p=0.0237)。表一,二展示了单变量和多变量的cox回归分析用于评估molGBM(表一)和histGBM(表二)对于FPS的保护和风险因素。
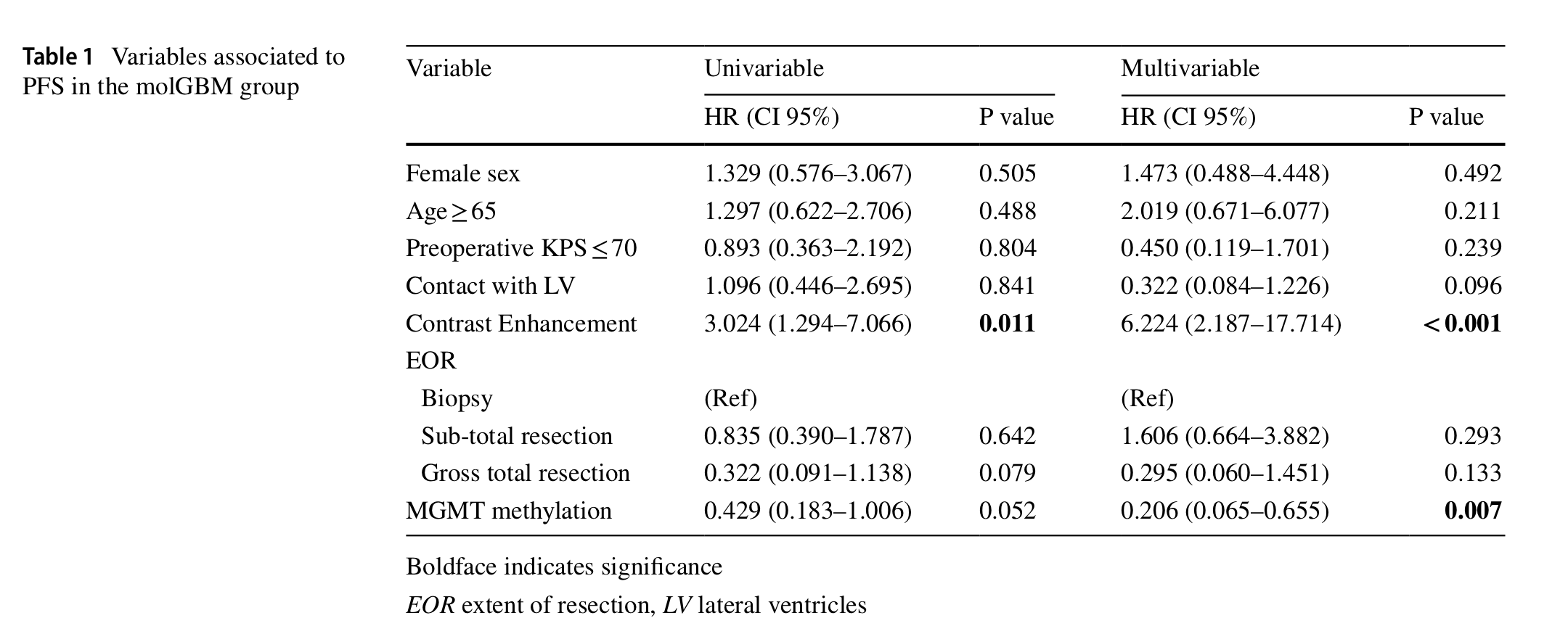
 在milGBM组中(表一):
在milGBM组中(表一):
单变量分析显示在MRI中对比度增强为PFS的风险因素(HR 3.024 [CI 95% 1.294–7.066], p = 0.011)。
单变量分析中,放射线相关的因素与PFS无关。
单变量分析中,即使没有显著相关性,但总体切除和MGMT基因甲基化表现出了PFS保护因子的趋势。
多变量分析显示,MRI中对比度增强为显著的PFS的风险因素。(HR 6.224 [CI 95% 2.187–17.714],p <0.001)
多变量分析中,MGMT基因甲基化为PFS的保护因素。(HR 0.026 [CI 95% 0.065–0.655],p = 0.007)
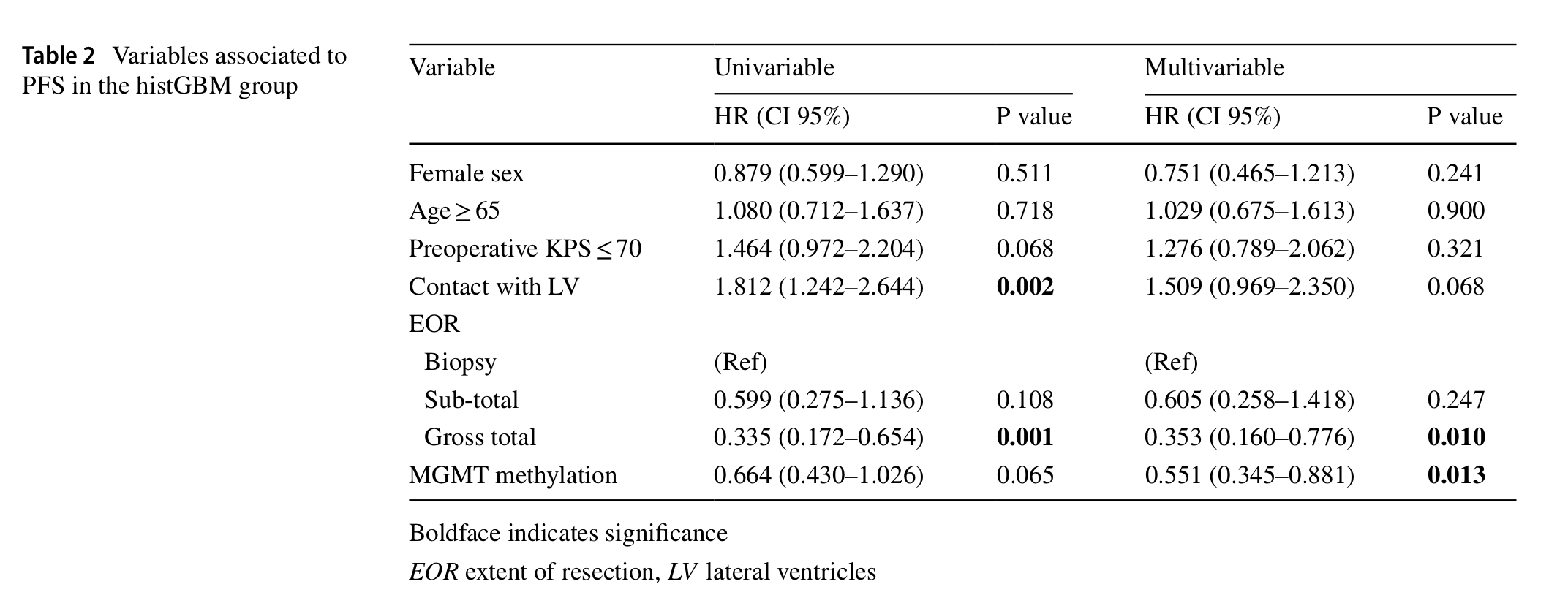
 在histGBM组中(表二):
在histGBM组中(表二):
单变量分析显示侧脑室 (LV) 的接触为FPS的风险因素。(HR 1.812 [CI 95% 1.242–2.644], p = 0.002)
单变量分析中,总体切除相对活检而言,为保护因素。(HR 0.335 [CI 95% 0.172–0.654], p = 0.001)
多变量分析显示,总体切除相对活检而言,为保护因素。(HR 0.353 [CI 95% 0.160–0.776],p=0.010)
多变量分析显示,MGMT基因甲基化相对活检而言,为保护因素。
molGBM与histGBM总体生存期OS相近
molGBM 组的中位 OS 为 26 个月,histGBM 组为 21 个月(图1)。与上一个结果相似,对OS使用COX回归分析风险/保护因素。
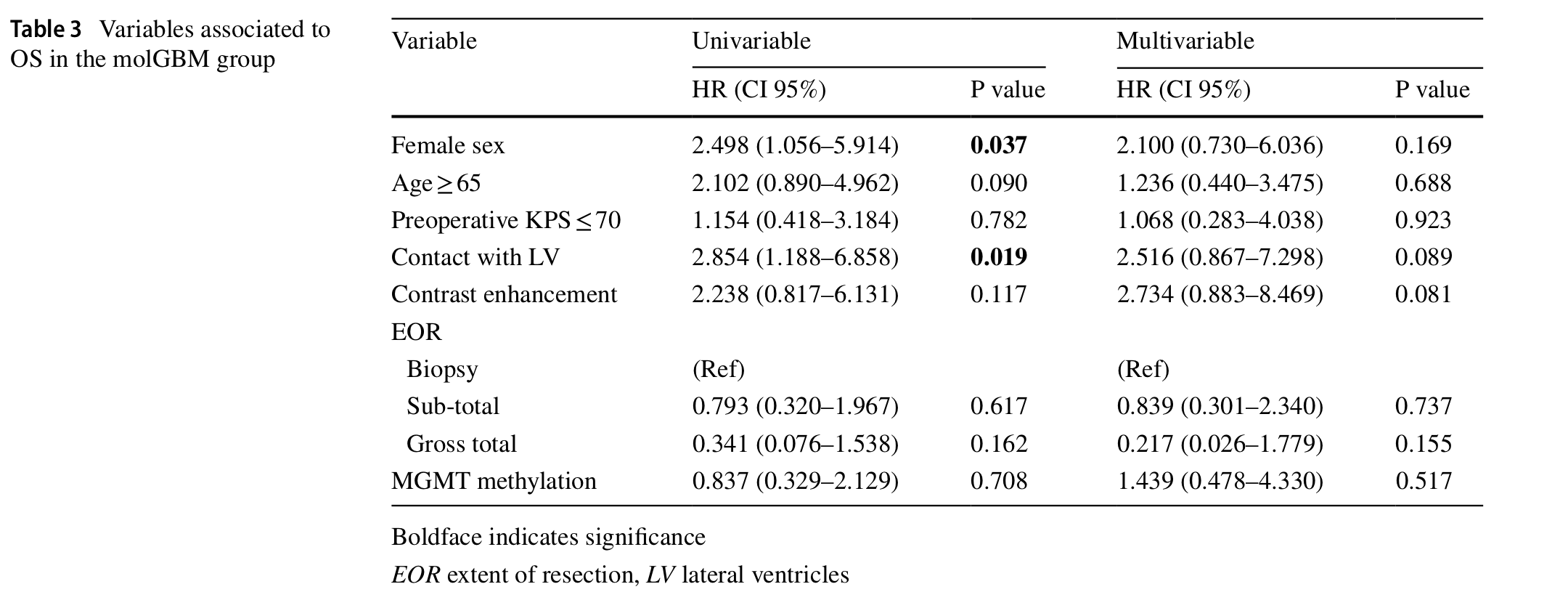
在在milGBM组中(表三):
单变量分析显示,性别(女性)和侧脑室 (LV) 的接触均为风险因素。
单变量中,放射线与OS均无显著相关。
多变量分析中,所有变量均无显著保护/风险相关。但对比度增强和侧脑室 (LV) 的接触表现出风险趋势。
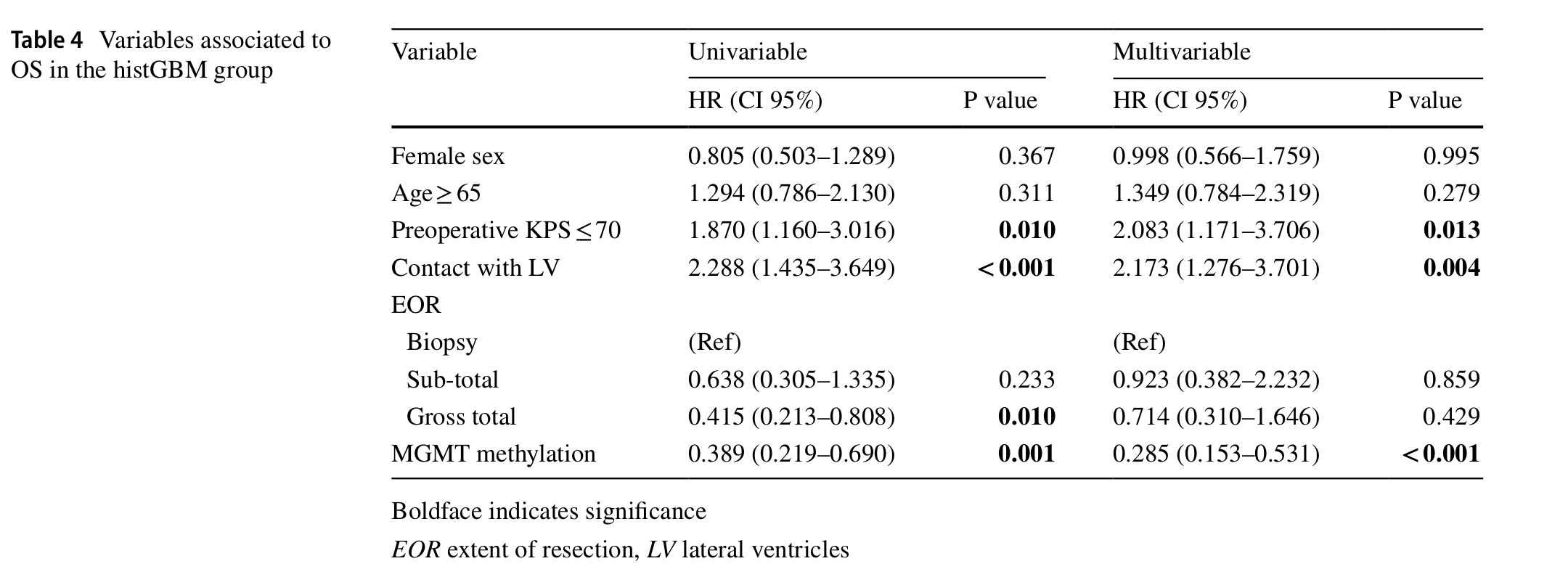
 在histGBM组中(表四):
在histGBM组中(表四):
单变量分析显示,术前KPS<=70和侧脑室 (LV) 的接触为风险因素。
单变量分析中,相对活检的总体切除和MGMT基因甲基化均为保护因素。
在多变量分析中,术前KPS<=70和侧脑室 (LV) 的接触仍为风险因素。
相对于单变量分析,多变量中仅有MGMT基因甲基化仍为保护因素。
特定的分子异常不影响生存结果
如图2所示,在 molGBM 组中,TERT 突变存在于 57 个肿瘤中,EGFR 扩增存在于 20 个肿瘤中, + 7/- 10存在于 12 个肿瘤中。 在这个亚组中,15 例肿瘤有 TERT 突变和 EGFR 扩增的组合,9 例有 TERT 突变和 + 7/-10 的组合,而没有一个肿瘤有包含 + 7/- 10 和 EGFR 扩增或 三种分子异常的组合。 在 histGBM 组中,TERT 突变存在于 130 个肿瘤中,EGFR 扩增存在于 61 个肿瘤中, + 7/- 10存在 38 个肿瘤中。 在这个亚组中,50 个肿瘤具有 TERT 突变和 EGFR 扩增的组合,34 个肿瘤具有 TERT 突变和组合 + 7/- 10 的组合,5 个具有组合 + 7/- 10 和 EGFR 扩增的组合 , 和 5 有三种分子异常的组合。
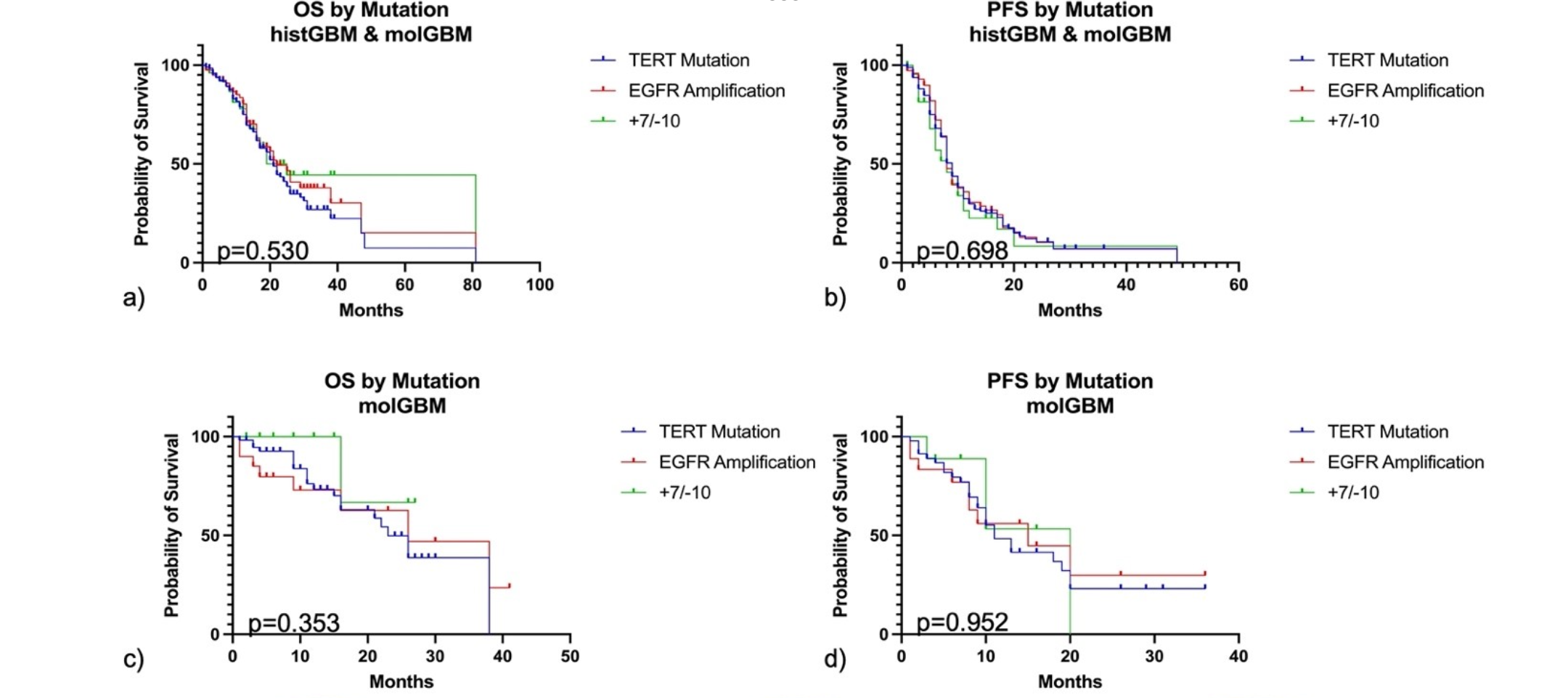
 为了评估OS或者PFS的差异,对每个异常分子(TERT
突变,EGFR 扩增或+7/-10)与OS或者PFS进行对数秩检验(log rank
test)。在所有的队列中(包括molGBM和histGBM),三个分子对OS和PFS均无显著差异(图3)。在单独的molGBM组中,也均无差异(图3)。
为了评估OS或者PFS的差异,对每个异常分子(TERT
突变,EGFR 扩增或+7/-10)与OS或者PFS进行对数秩检验(log rank
test)。在所有的队列中(包括molGBM和histGBM),三个分子对OS和PFS均无显著差异(图3)。在单独的molGBM组中,也均无差异(图3)。
Conclusion
在我们的多中心研究中,molGBM较histGBM的PFS更长,而OS相似。在亚组中,存在MRI证实的对比度差异为PFS的风险因素,而存在MGMT甲基化提高了PFS。需要进一步的研究来更好地表征molGBM患者的生存情况。