通过新的检测平台证实胶质瘤循环细胞及其相关簇为诊断标志物
Abstract
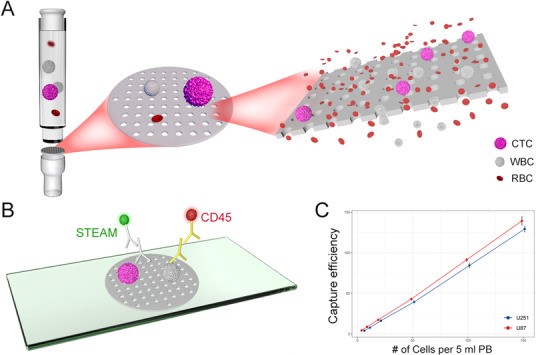
在本研究中,我们通过上皮肿瘤细胞的大小构建了了一个新的隔离方法,该方法通过使用生物相容性二烯烯聚合物膜携带在高流速下直径8㎛的气孔富集CTC。
Background
弥漫性胶质瘤是全球中枢神经系统肿瘤相关死亡的主要原因。作为一种非倾害性且便利的生物标记物,循环肿瘤细胞(CTC)和他的簇在肿瘤诊断方面展示了很大的可行性。但由于其隔离和识别仍具有挑战性,所以限制进一步的临床应用。因此,迫切需要一个可以对CTC及其簇进行有效识别的平台。
Result
为了测试装置捕获的效率,我们在U87和U251中加入健康人的血液样本。在U87细胞系浓聚物中每5ml加入5,10,20,50,100和150个细胞,其捕获效率分别为86.0%,87.0%,86.5%,86.0%,91.3%,92.9%。在U251细胞系中也可以观测到同样的结果(图1A-C)。
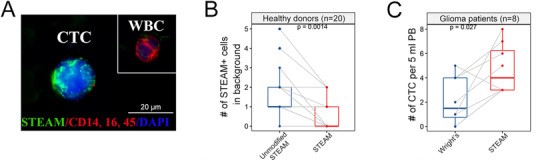
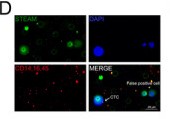
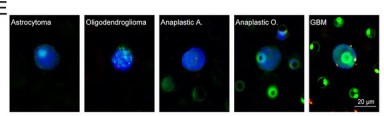
接下来,我们探究了在胶质瘤CTC上运用该方法的可行性。将他们的数据使用Wright's染色(一种被认可的方法),发现其并不能从其他脑肿瘤中区分胶质瘤的CTC。这表明,这种基于肿瘤特征的方法不能确定CTC的区域,限制了其诊断的价值(图4A-C)。然而, 靶向GBM来源的CTC的高度特定的识别方法如STEAM染色法(基于CTC和WBC的差异基因表达量的抗体混合物),由于健康细胞表达一些包含的标志物,将会导致假阳性的风险和高的背景水平(?)。因此,我们结合STEAM染色和一系列关键的CTC恶性特征,这种改良的STEAM法可以在小鼠实验和健康样本中显著地减少背景水平(图1D-F,2A-B,4D),并且较Wright's染色而言,更具有敏感性(图2C)。
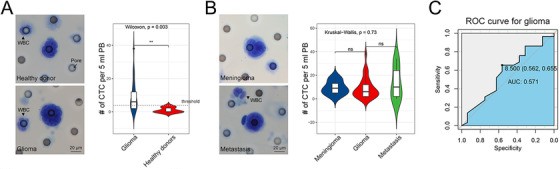
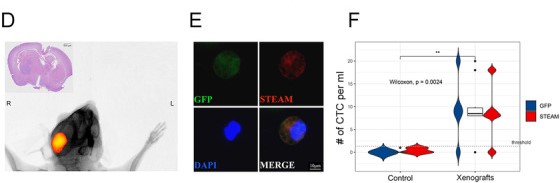
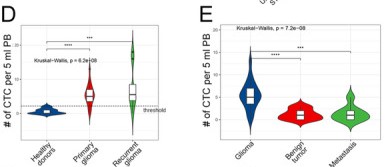
接下来,我们通过临床测试来校验上述平台在胶质瘤应用中的可行性。对于42例弥漫性原发胶质瘤患者,大约85.7%(36/42)检测出CTC,显著高于之前的研究(图2D)。对于继发性胶质瘤患者,有7/8(87.5%)检测出CTCs超过阈值(图2D)。为了进一步研究我们的平台对于不同诊断的可行性,我们使用20例良性肿瘤和8例脑转移瘤患者的临床数据。我们发现在胶质瘤中STEAM阳性CTC的水平显著高于上述提到到的脑肿瘤(P<0.0001)(图2E)。并且ROC曲线显示了我们的平台预测在胶质瘤CTC中的价值。
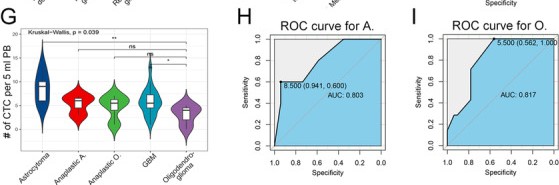
与之前的结果相反,在五个胶质瘤亚型中,我们在星形细胞瘤发现高水平的CTC,而在少突胶质细胞瘤中则是低水平的CTC(图2G-I,4E)。这一结果显示了使用CTC预测肿瘤病理亚型具有很大的潜力。在大规模队列中验证之后,这可以使诊断更加精确。
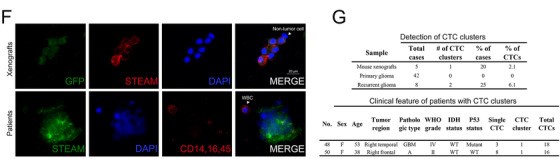
接着,我们证实是否CTC簇在胶质瘤中具有某些固有性质。与出现比例极低的CTC-CTC簇相比,CTC-WBC簇发生地更加频繁(图3A,4F-G)。这是第一次报道在胶质瘤患者中出现大量的CTC-WBC簇。先前的研究中有报道CTC可以与中性粒细胞结合进入细胞循环的进程,强调CTC’s通过在非肿瘤细胞建立稳定的根基(?)从而可以在失巢凋亡和免疫检测中逃离的能力。我们发现大约有33.3(14/42)的原发性胶质瘤患者有CTC-WBC簇(图3B)。在继发性患者中,这一比例增长到了75%(6/8)(图3B)。表明CTC-WBC簇可以帮助监测追踪继发性胶质瘤。然而,在区分不同肿瘤亚型方面,其并没有统计的显著性(图3C)。之后,我们对一例血液样本进行Wright&Giemsa染色,显示CTC通过中性粒细胞与WBCs相关联,这与之前的研究结果一致。

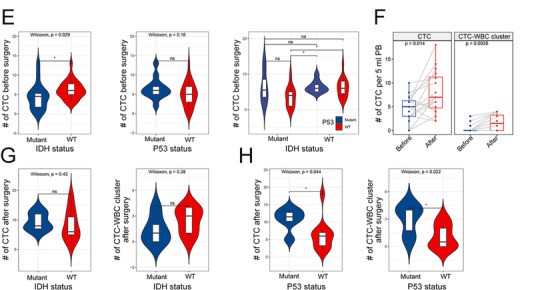
接下来,我们进一步研究CTC与患者临床特征的相关性。我们的数据表明,CTC的表达水平与IDH状态以及差的预后相关(P<0.05)(图3E)。有趣的是,我们观察到在切除肿瘤后的两周,CTC和CTC簇显著增长。这表明切除可能促使CTC进入循环(图3F)。此外,手术后的CTC和CTC-WBC簇的表达水平与P53突变的相关程度大于IDH(P<0.05)(图3G)。这些结果表明,更高水平的CTC和CTC簇并不是良好的预测因子。
Conclusion
总之,我们提出了一个新的有效的平台用于检测胶质瘤中的CTC及CTC簇,并且该平台(较以前的方法)还具有更高的敏感性和特异性。我们证实STEAM阳性CTC对胶质瘤而言是一种高度特异性的诊断标志物。在某些情况,较之活检与MRI,具有更高的优越性。我们的结果使液体活检在临床应用方面更具有新的希望。在大队列验证后,CTC可以在病理学亚型和分子诊断方面进一步发挥作用。
尽管先前的研究表明,CTC-WBC簇具有亲瘤效应,但是其在胶质瘤中的作用仍是未知的。因此我们需要与之相关的研究来理解和评估其的临床作用。
我们的结果大大拓展了循环肿瘤细胞及其簇在临床方面的应用,这可能可以连接CTC的理论研究与临床实践的应用。
Reference:Identifying circulating glioma cells and their clusters as diagnostic markers by a novel detection platform